Calcium hydroxylapatite (CaHA)「以Radiesse为例」主成分是直径25-45微米的羟基磷灰石钙微晶球,是一种高温烧制的生物陶瓷。除了含有30%的CaHA微球外,剩下的70%是主要由水(用于注射的无菌水)、甘油和羧甲基纤维素钠(CMC)组成的凝胶基质组成。微晶瓷外层被粘稠状的凝胶物质包覆,进入组织后会形成骨架,并刺激胶原蛋白增生攀附在骨架上,具有良好的生物相容性,不易过敏,安全性高,疗程后恢复期短,伤口小,不需特地加强保湿。在这里CaHA微球的作用有三点:(1)充填,(2)刺激胶原蛋白和弹力蛋白产生,(3)以及通过成纤维细胞作用导致的紧致肌肤效应。
1.羟基磷灰石微球外观[1]:
特征:25-45微米的颗粒小且表面光滑,可以减少注射过程中的皮肤创伤和严重副作用(包括肉芽肿)的发生。这个尺寸是避免巨噬细胞吞噬的最佳尺寸,注射部位观察到的巨噬细胞很少。

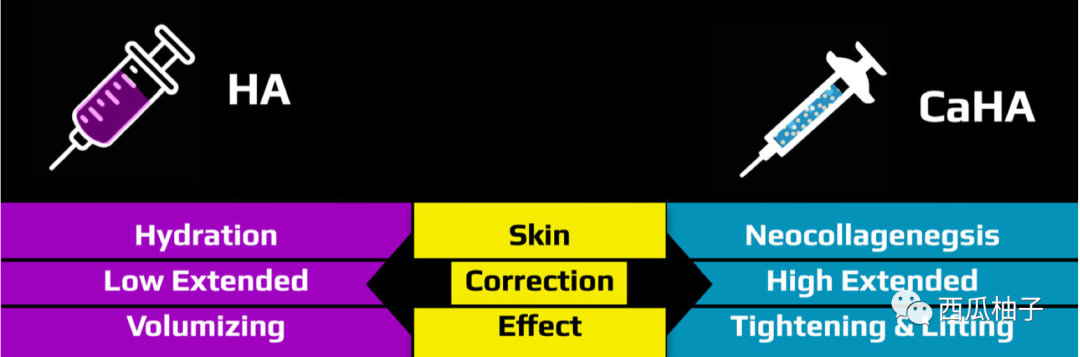
2.与透明质酸填充物的对比(紧致、提升效果显著,长效)[2]
与目前常用的玻尿酸等注射式植入剂相比,Radiesse的维持效力更长,具有填补功能,可改善皮肤凹陷、不满饱的情况。
3.降解机制(颗粒尺寸)[1]:
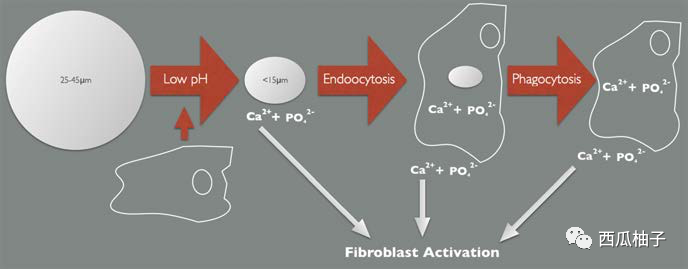
成纤维细胞无法内吞25-45微米的微球,因此被激活释放降低pH值的细胞因子。由于组织pH值降低,CaHA溶解成钙和磷酸根离子。钙离子通过已知通路激活成纤维细胞。另一方面,当微球小于15微米足以被吞噬时,它会被巨噬细胞吞噬,粒子进一步在吞噬细胞内被降解。
4.Radiesse的发展历史
1990年代初,一种名为Coaptite的CaHA产品(由百时美施贵宝研发)被用于治疗尿失禁。1999年,这项技术被美国BioForm Medical公司收购,并进一步开发面部适应症,直到2001年第一个患者接受治疗。2003年,FDA批准了一种名为Radiance的产品,后来重新命名为RADIESSE。在美容领域,RADIESSE于2004年首先获得EMA批准作为医疗器械。2006年,其获得CE认证,可用于塑形和重建外科,用于面部深层真皮和皮下软组织充填。同年,FDA批准RADIESSE用于治疗中度至重度皱纹和皱折,如鼻唇沟,以及用于人类免疫缺陷病毒(HIV)患者脂肪减退的恢复和/或矫正。2015年,FDA还批准RADIESSE用于非面部适应症,如手部增大。2009年,生产公司BioForm Medical被德国制药公司Merz Pharma收购,RADIESSE在全球多个市场重新推出,导致销售额大幅增长。RADIESSE的专利配方带来了十年的垄断。2013年,CaHA产品的市场对其他生产商开放。自2003年引入CaHA产品以来,配方一直未变,直到2016年在美国市场发布了利多卡因化版本,之后在全球推广。到2018年,至少还有两家制造商开始按RADIESSE的规格生产CaHA产品。因此,RADIESSE在软组织内填充运用有非常丰富的临床运用。
5.中国国内的新闻
Merz 有望推出国内首款羟基磷灰石微球填充剂。

6.总结
在医美领域,目前市面上的填充材料主要分为两大类:合成材料如硅胶、PMMA、聚丙烯酰胺水凝胶、聚乳酸等;生物材料如胶原、透明质酸、自体脂肪等。2006年通过美国FDA认证的Radiesse微晶瓷被认为是一种理想的半固体非手术面部填充材料,具有生物相容性良好、注射部位会形成新的天然组织、效果维持时间比其他填充剂更长等优点,在安全性方面,甚至可与短效的玻尿酸产品媲美。Radiesse微晶瓷由70%的半固态凝胶和30%的羟基磷灰石钙微球组成,后者是人体内固有成分,前者则是将25~45μm的羟基磷灰石钙微球悬浮于以水和甘油为主要成分的凝胶载体中形成,并通过添加少量的羧甲基纤维素钠调节凝胶结构。2020年9月30日公布的《2020年第二批医疗器械产品分类界定结果汇总》显示,用于面部美容的骨膜填充微整形产品中,含有羟基磷灰石钙微球、透明质酸钠和水的“下颌骨骨膜填充用羟基磷灰石生物陶瓷”应按III类器械管理,分类编码为13-09。该产品中的羟基磷灰石钙微球悬浮于透明质酸钠和水组成的凝胶状载体中,可固定于注射部位一段时间,提供支撑力,随后被人体吸收代谢。
参考资料:
[1] Calcium Hydroxylapatite Soft Tissue Fillers: Expert Treatment Techniques[M]. CRC Press, 2020.
[2] Fakih-Gomez N, Kadouch J. Combining calcium hydroxylapatite and hyaluronic acid fillers for aesthetic indications: efficacy of an innovative hybrid filler[J]. Aesthetic plastic surgery, 2022: 1-9.